Aktuelle Themen
Kategorie auswählen
Für Menschen da sein

Sie helfen dabei, dass alle Menschen - Betroffene, Angehörige, Besorgte und Interessierte - bei uns individuelle Beratung und Beistand erhalten.
Im Wettlauf gegen das Vergessen: CIM med Charity Lauf 2024
Laufend Gutes tun - das war im Frühjahr 2024 ganz einfach!
Im Aktionszeitraum vom 7. bis 21. März machten sich 256 Teilnehmer aus 7 Nationen auf den…
[mehr lesen]EAAW 2024: AFI organisiert Workshop für wissenschaftlichen Nachwuchs
Erstmalig findet vom 17. bis 21. März gemeinsam mit unseren Partnerorganisationen Alzheimer Nederland und Fondation Vaincre Alzheimer der European…
[mehr lesen]Forschen gegen das Vergessen – Wir fördern 12 neue Forschungsprojekte
Kann man den Verlauf der Alzheimer-Krankheit durch eine gesunde Lebensweise verlangsamen? Wie lässt sich eine Chronisch Traumatische Enzephalopathie…
[mehr lesen]Studie: Keine Ansteckungsgefahr bei Alzheimer
Am 29. Januar berichteten britische Wissenschaftlerinnen und Wissenschaftler in der Zeitschrift "Nature Medicine", dass es in seltenen Fällen möglich…
[mehr lesen]Weihnachten mit Alzheimer-Erkrankten feiern
Weihnachten ist für viele Menschen das Fest der Familie. Ist eine Angehörige oder ein Angehöriger an Alzheimer erkrankt, kann das die Familie an den…
[mehr lesen]AFI ist ein “Great Place To Work”!
Die Alzheimer Forschung Initiative darf sich zum zweiten Mal über die Zertifizierung als „Great Place To Work“ freuen. Das Zertifizierungsprogramm…
[mehr lesen]Ausgezeichnet! AFI-Forscher Prof. Klaus Gerwert bekommt NRW-Innovationspreis
Für die Entwicklung eines Alzheimer-Frühtests ist Klaus Gerwert mit dem Innovationspreis des Landes Nordrhein-Westfalen (NRW) ausgezeichnet worden.…
[mehr lesen]Münchener Alzheimer-Forscher Prof. Dr. Johannes Levin erhält Helga Steinle-Preis
Am 12. September wurde zum dritten Mal der Helga Steinle-Preis verliehen. Stifter Dieter Steinle und Preisträger Prof. Dr. Johannes Levin trafen sich…
[mehr lesen]Lecanemab & Donanemab: Alzheimer-Wirkstoffe im Check
Es ist kompliziert: Obwohl Alois Alzheimer die Krankheit des Vergessens schon 1906 erstmals beschrieben hat, wissen wir immer noch nicht genau, wie…
[mehr lesen]Vertrauen ist gut, Kontrolle ist besser: Jahresbericht 2022 erschienen
Sie wollten uns immer schon einmal auf den Zahn fühlen? Mit unserem Jahresbericht 2022 haben Sie jetzt die Gelegenheit dazu.
[mehr lesen]Aktion Weihnachtshase: EDEKA übergibt 200.000 Euro-Scheck an AFI
Mit Schokohasen gegen Alzheimer: Bei der diesjährigen Oster-Spendenaktion von EDEKA erzielte der Verkauf der "Weihnachtshasen" eine Spendensumme von…
[mehr lesen]Neighbours by Dorint Stiftung: 20.000 Euro für die AFI
Wir freuen uns sehr über eine Spende von 20.000 Euro, die Christiane Eichner im Rahmen einer großen Spendengala am vergangenen Samstag von der…
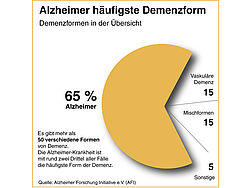
[mehr lesen]Weltweit 55 Millionen Demenzkranke (2023)
Die Zahl der Menschen mit Demenz nimmt weiter zu. Nach Angaben der WHO leben derzeit weltweit mehr als 55 Millionen Menschen mit einer Demenz und…
[mehr lesen]7 Irrtümer über die Alzheimer-Krankheit
Aufklärung über die Alzheimer-Krankheit ist uns ein wichtiges Anliegen. Immer noch gibt es viel Verunsicherung im Zusammenhang mit der Krankheit des…
[mehr lesen]Projektförderung 2024: Insgesamt 72 Anträge eingegangen
Nur Forschung bringt Heilung: Insgesamt 72 Wissenschaftlerinnen und Wissenschaftler bewerben sich in diesem Jahr um unsere Forschungsförderung. Diese…
[mehr lesen]Zulassung Lecanemab (Leqembi) in den USA
Der Alzheimer-Wirkstoff Lecanemab ist in den USA von der Food and Drug Administration (FDA) in einem beschleunigten Verfahren zugelassen worden.
[mehr lesen]Ein Health:Angel für die AFI
Der „Health:Angel“, wow. Wir freuen uns sehr über diesen tollen Award, den wir gemeinsam mit unserer Botschafterin Okka Gundel in Empfang nehmen…
[mehr lesen]Checkliste: Fit am Steuer in der dunklen Jahreszeit
Nebel, Glatteis, Schnee: Die dunkle Jahreszeit ist für Autofahrerinnen und Autofahrer mit besonderen Herausforderungen und einem erhöhten Unfallrisiko…
[mehr lesen]10 Jahre im Einsatz gegen Alzheimer - Danke, Okka!
Seit 10 Jahren ist Okka Gundel Botschafterin für die Arbeit der Alzheimer Forschung Initiative. Von Anfang an war ihr Einsatz geprägt von ihrer…
[mehr lesen]20.000 Euro für bleibende Erinnerungen - Saal Digital unterstützt großzügig unsere Forschungsförderung
Mit ihren Fotobüchern, Wandkalendern und Fotogeschenken sorgt Saal Digital dafür, dass Erinnerungen bleiben. „Unsere Kundinnen und Kunden wollen…
[mehr lesen]Zum Welt-Alzheimertag: Wo steht die Alzheimer-Forschung?
Düsseldorf – Wie hältst Du es mit der Amyloid-Hypothese? Das ist zurzeit eine der Gretchenfragen in der Alzheimer-Forschung. Weltweit diskutieren…
[mehr lesen]Forschungsförderung: 24 Anträge in der engeren Auswahl
Forschen gegen das Vergessen: Weiterhin Hoffnung auf eine Förderung ihrer Forschungsprojekte dürfen 24 Wissenschaftlerinnen und Wissenschaftler haben.…
[mehr lesen]Aufregung in der Alzheimer-Forschung: Was ist dran an den Beta-Amyloid Fälschungen?
Dem Neurowissenschaftler Sylvain Lesné von der Universität in Minnesota (USA) wird vorgeworfen, in Studien aus dem Jahr 2006 Forschungsergebnisse zum…
[mehr lesen]Alzheimer-Wirkstoff Crenezumab gescheitert
Eine laufende Studie mit dem Alzheimer-Wirkstoff Crenezumab hat nicht die erwarteten Ergebnisse erzielt. Der Wirkstoff konnte bei den…
[mehr lesen]„Friendly Fire“: Über 250.000 Euro für Alzheimer Forschung Initiative
Spielen und Streamen für die Alzheimer Forschung: Wir freuen uns sehr über eine Spende von rund 252.102 Euro, die beim Charity-Livestream „Friendly…
[mehr lesen]